



Różnorodność materii
Wszystko w Twoim pokoju jest zbudowane z niewielkiej liczby składników, jak węgiel, tlen itd. I te składniki tworzą dużą rozmaitość materiałów, będących ciałami stałymi, cieczami i gazami. Twój komputer, stół, okno ... wszystkie te przedmioty są zrobione z ciał stałych. Napoje są płynami, a powietrze którym oddychasz jest gazem. Twoje własne ciało zawiera materiał we wszystkich trzech fazach: stałej, ciekłej i gazowej.
Trzy stany materii: stały (szkło), ciekły (piwo) i gazowy (bąbelki dwutlenku węgla, nie wspominając o powietrzu wokół!

Niespodziewanie, większość widzialnego Wszechświata nie składa się z ciał stałych, płynów lub gazów. Słońce i gwiazdy tworzy plazma – czwarty stan materii. Inną plazmą jest jarzący się ośrodek w lampach neonowych i, oczywiście, ten znajdujący się w zabawkach: kulach plazmowych.
Jaka jest różnica pomiędzy plazmą i gazem?
Plazmy są na ogół bardzo gorące, rzeczywistą różnicę wyjaśnimy jednak nieco dalej.

jest kulą bardzo gorącej plazmy

Pozostałe rurki zawierają plazmy innych gazów.
Skłaniamy się ku temu, by przyjmować za oczywisty fakt, że wiele substancji może zmieniać swój stan, ale zawsze pozostają tymi samymi. Kiedy na przykład gotujemy wodę, część z niej, parując, zawierusza się gdzieś w wolnej przestrzeni. Kiedy jest zimno na dworze, część z niej może skroplić się na Waszym oknie, zmieniając się ponownie w wodę. Kiedy wyniesiemy wodę na mróz - może zamienić się w lód. Ale kiedy wniesiemy lód do ciepłego pomieszczenia, ten, topniejąc, zamieni się ponownie w taką samą wodę, jaka była przedtem *).
Woda z morza wyparowała dzięki Słońcu. Niewidzialna para wodna zamieniła się ponownie w małe kropelki wody, które widzimy jako chmury.
*) Lód także sublimuje, tzn., że jego cząsteczki mogą uwolnić się bezpośrednio do atmosfery. Oba procesy: topnienia i sublimacji zależne są także od ciśnienia zewnętrznego.
Ilekroć byśmy nie zmienili wodę w parę lub lód, ona będzie zawsze tą samą wodą, gdy powróci do swej ciekłej postaci. Ona nigdy nie niszczeje! W rzeczywistości, woda parowała i skraplała się w kółko przez miliony lat, ale wciąż jest tą samą wodą. To może wyglądać prosto i jasno, ale to jest bardzo doniosłe. Musi być coś, co jest i w lodzie, i w wodzie, i w parze wodnej. Ale co to jest?
Góra lodowa najpierw była wodą morską, potem parą wodną, następnie kropelkami w chmurach, a dalej śniegiem, by wreszcie stać się pływającym lodem. Wkrótce będzie znowu wodą morską.

Wodę tworzy wielka liczba cząsteczek wody, które mają średnicę rzędu 10-10 metra. Gdyby każdą cząsteczkę w kropli wody powiększyć do rozmiarów winogrona, wtedy kropla urosłaby do rozmiarów pokaźnego państwa.
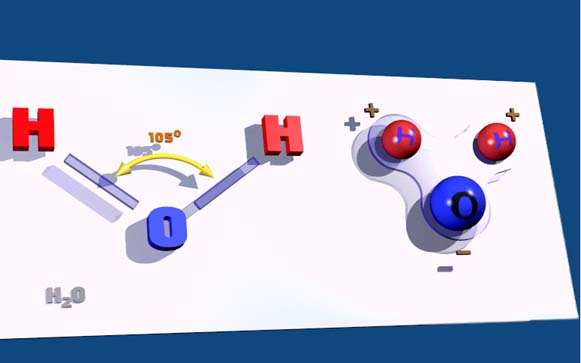
Każda cząsteczka wody zawiera jeden atom tlenu i dwa atomy wodoru, ustawione jak na rysunku. Wszystkie cząsteczki wody są takie same. Nawet jeśli cząsteczka wody rozpadnie się na atomy, co może się zdarzyć w bardzo wysokiej temperaturze, to jest tylko jeden sposób, w jaki atomy mogą połączyć się ponownie: utworzenie innej cząsteczki wody.
Różnica pomiędzy lodem, ciekłą wodą i niewidoczną parą wodną zależy od tego, jak ciasno upakowane są cząsteczki.
Oto jak dwa atomy wodoru i atom tlenu są rozmieszczone w cząsteczce wody, H2O.
Kiedy woda jest oziębiona do zera stopni Celsjusza, cząsteczki poruszają się powoli: zbyt wolno by pokonać siły je wiążące. Oto dlaczego góra lodowa jest tak twarda, że może zatopić statek.
Może się zdarzyć, że gdy w windzie stłoczy się zbyt wielu pasażerów, nie będą mogli się ruszyć. Cząsteczki wody w krysztale lodu są w nieco podobnej sytuacji. To jest tak, jakby każda z cząsteczek wody była uwięziona, ramię w ramię, ze wszystkimi cząsteczkami wokół, i pozostawała w tym samym miejscu kryształu.
Istnieje pewna siła pomiędzy każdą cząsteczką wody i jej sąsiadkami, i jeśli temperatura jest dość niska, siła ta utrzymuje je razem w postaci zestalonej.
Czasami cząsteczki wody ustawiają się w piękne formy, jak w tym płatku śniegu.

http://www.markcassino.com
Kiedy jakiś materiał robi się cieplejszy, cząsteczki poruszają się żywiej. Kiedy podgrzewasz materiał powyżej jego temperatury topnienia, cząsteczki oddzielają się od swoich sąsiadów, jak goście na przyjacielskim spotkaniu, gdzie każdy chce porozmawiać z każdym. Ponieważ są przyjaciółmi, nie opuszczają przyjęcia, choćby się nawet robiło zbyt gorąco.
Kiedy woda jest ogrzana powyżej 0ºC cząsteczki poruszają się zbyt gwałtownie by być zamkniętymi w krysztale lodu. Dopóki nie zrobi się zbyt gorąco cząsteczki płynu wciąż pozostają razem, jak krople wiszące z kranu.
W cieczach, siły międzycząsteczkowe mogą utrzymać krople w całości, ale nie mogą zmusić cząsteczek do pozostawania w jednym miejscu w kropli.

http://www.fotogaleria.regionet.pl
Ale jeśli woda jest ogrzana (przy normalnym ciśnieniu!) powyżej 100ºC , wtedy cząsteczki poruszają się tak prędko, że wspólnie opuszczają powierzchnię płynu, przyjęcie się rozpierzcha. Tak się właśnie dzieje, gdy woda wrze.
Nawet poniżej tej temperatury, niektóre cząsteczki będą się poruszały dość szybko, by opuścić powierzchnię cieczy. To zjawisko nosi nazwę parowania. Bez niego nic by nie wysychało. Nie byłoby deszczu na Ziemi, gdyby cząsteczki wody nieustannie nie wyrywały się na wolność z powierzchni mórz, stając się parą wodną. Potem cząsteczki znowu łączą się ze sobą, gdy para wodna kondensuje w postaci kropelek wody w chmurach.

Photo by cottonbro from Pexels
Gdyby cząsteczki wody podgrzać do temperatury powierzchni Słońca, nie istniałyby długo! Tak jest dlatego, że ich średnia prędkość byłaby tak duża, że przy zderzeniach z innymi atomami lub cząsteczkami rozpadałyby się na dwa atomy wodoru i jeden atom tlenu. Gdyby atomy były wciągnięte głębiej w Słońce, gdzie temperatury sięgają milionów stopni, poruszałyby się wówczas tak szybko, że elektrony byłyby wybijane z atomów i te ulegałyby jonizacji.
Cząsteczki wody nie trwają długo na powierzchni Słońca.
Plazma w rurze wyładowczej jest również niesprzyjającym środowiskiem dla cząsteczek wody.


Równie łatwo, jak znajome ciała stałe, ciecze i gazy, krótko wspomnieliśmy "czwarty stan skupienia materii" – plazmę. Czym jest plazma?
Kiedy atomy utracą część elektronów, nazywamy je zjonizowanymi. Elektrony mają ujemny ładunek, więc kiedy je wybijemy z atomu, pozostały atom będzie miał ładunek dodatni. Jeżeli wiele atomów gazu jest zjonizowanych, zbiór dodatnich jonów i elektronów zachowuje się inaczej niż zwykły gaz i nazywamy go inaczej: to już jest plazma. Gwiazdy w większości utworzone są z plazmy.
Plazmę możesz znaleźć w lampach neonowych i kulach plazmowych, które można kupić.
Możesz kupić kulę plazmową by rozbawić swoich przyjaciół

Wszystko, co widzimy wokół nas jest zbudowane z niewielu składników uporządkowanych na pozornie nieskończoną liczbę sposobów. Na końcu następnej lekcji postawimy dwa istotne pytania w tej materii.
Wszystko w tym pokoju jest wykonane z kilku składników zestawionych na wiele sposobów. Skąd te składniki pochodzą?



 Raymond Mackintosh jest Nowozelandczykiem zamieszkałym w Zjednoczonym Królestwie Wielkiej Brytanii. Ukończył studia w Auckland, a pracę doktorską obronił na Uniwersytecie Kalifornijskim w Berkeley. Od wielu lat prowadzi badania z fizyki jądrowej, od 1979 roku naucza na Otwartym Uniwersytecie w UK.
Raymond Mackintosh jest Nowozelandczykiem zamieszkałym w Zjednoczonym Królestwie Wielkiej Brytanii. Ukończył studia w Auckland, a pracę doktorską obronił na Uniwersytecie Kalifornijskim w Berkeley. Od wielu lat prowadzi badania z fizyki jądrowej, od 1979 roku naucza na Otwartym Uniwersytecie w UK.