



Promieniotwórczość: co to takiego?
W jaki sposób możemy dowiedzieć się, czym jest promieniotwórczość? Cząstki są tak maleńkie!
Promieniotwórczość pojawia się, gdy niewyobrażalnie małe atomy wysyłają jeszcze mniejsze cząstki lub tajemnicze fale. Te cząstki i fale są całkowicie niewidoczne dla ludzkiego oka.
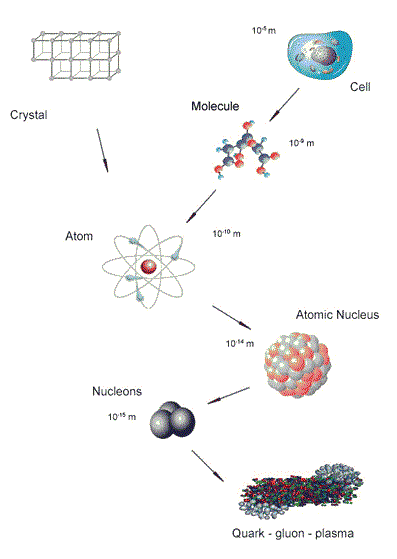
W rzeczywistości, jak odkryjemy, to właśnie jądro w centrum atomu emituje cząstki, a każde jądro jest około 10 tysięcy razy mniejsze niż atom.
Jak więc można się dowiedzieć, czym jest promieniotwórczość?
Czym są emitowane cząstki i fale, które nazywamy "promieniowaniem jądrowym", ponieważ pochodzi z jądra atomowego?
Co się dzieje w atomach (w istocie - w jądrach atomowych każdego atomu), kiedy emitują one cząstki?
Copyright: Behacker & Partner
Wiedzę o naturze czerpiemy z doświadczeń – promieniotwórczość jest częścią natury.
Zacznijmy od pytania:
Czym jest promieniowanie jądrowe?
Cała wiedza naukowa pochodzi z eksperymentów i obserwacji.
Zacznijmy więc od obserwacji poczynionych wkrótce po odkryciu promieniotwórczości. Właśnie wtedy dokonano wiele istotnych odkryć dotyczących promieniotwórczości i substancji promieniotwórczych.
Antoine Henri Becquerel urodził się w Paryżu 15 grudnia 1852 roku jako członek wybitnej rodziny uczonych. W 1986 roku dokonał odkrycia zjawiska promieniotwórczości naturalnej. Odziedziczył po ojcu zapas soli uranu, które świeciły po wystawieniu na światło. Kiedy sole były umieszczone koło płyty fotograficznej osłoniętej czarnym papierem, wywołały jej zaczernienie. To zjawisko okazało się powszechne dla wszystkich badanych soli uranu i uznano, że jest własnością atomów uranu. Później Becquerel wykazał, że promieniowanie emitowane przez uran jonizuje gazy i różni się tym od promieni X, że może być odchylane przez pola elektryczne i magnetyczne. Za odkrycie spontanicznej promieniotwórczości naturalnej Becquerel był nagrodzony Nagrodą Nobla z fizyki (ex aequo z Marią i Piotrem Curie prowadzącymi badania w tej samej dziedzinie). Antoine Henri Becquerel zmarł w Le Croisic 25 sierpnia 1908 r.
Maria Skłodowska-Curie (1867-1934)
Francuzka Polskiego pochodzenia (Polski czytelnik ma na ten temat inne zdanie - polskość Marii Skłodowskiej-Curie nie ulega bowiem wątpliwości - przyp. tłum.). W roku 1891 opuściła Polskę, aby kontynuować studia na Paryskiej Sorbonie (słowo "kontynuować" nie jest właściwe - jako kobieta, Maria Skłodowska nie mogła studiować czegokolwiek na jakimkolwiek wydziale rosyjskich uniwersytetów - przyp.tłum), gdzie otrzymała licencjaty z fizyki i matematyki. W roku 1895 poślubiła Piotra Curie, profesora fizyki (w roku 1895 Piotr Curie nie był jeszcze profesorem - przyp.tłum.). Została następcą swego męża na stanowisku Kierownika Laboratorium Fizyki na Sorbonie, w roku 1903 otrzymała tytuł doktora nauk (habilitowanego wg polskiej nomenklatury - przyp.tłum.), a w roku 1906 (1908 - przyp.tłum.) została - jako pierwsza kobieta na tym stanowisku - profesorem fizyki ogólnej na Wydziale Nauk Przyrodniczych. Została również mianowana na stanowisko Dyrektora Laboratorium Curie w założonym w 1914 roku Instytucie Radowym Uniwersytetu Paryskiego (Instytut Radowy był utworzony wspólnie z Instytutem Pasteura i miał dwa wydziały: medyczny i fizyko-chemiczny. Maria Skłodowska-Curie była dyrektorem tego drugiego - przyp.tłum.) Odkrycie promieniotwórczości przez Henri'ego Becquerela zainspirowało małżonków Curie do badań, które zaowocowały wyodrębnieniem polonu i radu. Pani Curie rozwinęła metody otrzymywania czystego radu i charakteryzowania jego własności, w szczególności własności terapeutycznych. Podczas I Wojny Światowej pani Curie, w towarzystwie swej córki Ireny, poświęciła się pracy terapeutycznej (raczej organizacji służb radiologicznych, a jak sama pisała w liście do siostry - na badania terapeutyczne brakowało jej czasu - przyp. tłum.). Zyskała sobie podziw i wielki szacunek całego ówczesnego świata uczonych (różnie z tym bywało - przyp. tłum.). Od roku 1922 była członkiem Międzynarodowej Komisji Współpracy Intelektualnej w Lidze Narodów. Wraz z mężem otrzymała Nagrodę Nobla z fizyki w roku 1903 za badania nad promieniotwórczością naturalną. W roku 1911 otrzymała drugą Nagrodę Nobla, tym razem z chemii, w uznaniu prac nad radem.
Piotr Curie uzyskał stopień doktora nauk w roku 1895 na Sorbonie i został powołany na stanowisko profesora fizyki (to stało się dopiero po otrzymaniu Nagrody Nobla w 1904 r - przyp.tłum.) We wczesnych badaniach z zakresu krystalografii Piotr Curie - wraz ze swym bratem Jakubem - odkrył efekt piezoelektryczny. Następnie rozwinął teorię symetrii w odniesieniu do niektórych zjawisk fizycznych i skoncentrował swą uwagę na zjawisku magnetyzmu. Wykazał On, że własności magnetyczne danej substancji zmieniają się w pewnej temperaturze - temperatura ta znana jest obecnie pod nazwą temperatury Curie. Do prowadzonych przez siebie doświadczeń skonstruował kilka precyzyjnych urządzeń - wagi i elektrometry, w których zastosowano kryształy piezoelektryczne itd. Badania substancji promieniotwórczych prowadził wraz ze swą żoną Marią, którą poślubił w roku 1895. Swoje odkrycie radu i polonu i wydzielanie tych pierwiastków z blendy smolistej (naturalnych minerałów zawierających uran - przyp.tłum.) ogłosili w roku 1908, a następnie włożyli wiele wysiłku w wyjaśnienie własności radu i produktów jego przemiany. Ich praca w tej dziedzinie stworzyła podstawę wielu późniejszych badań z zakresu fizyki i chemii jądrowej. W roku 1903 przyznano im obojgu (wspólnie z Henri Becquerelem - przyp.tłum.) Nagrodę Nobla za badania nad promieniotwórczością naturalną. 19 kwietnia 1906 roku Piotr Curie zginął potrącony przez furgon w pobliżu mostu Pont Neuf w Paryżu.


2.1. Promieniowanie jądrowe zaczernia błonę fotograficzną
Wyobraź sobie, że bierzesz bryłkę uranu, lub kryształ związku zawierającego uran, i umieszczasz je wprost na błonie fotograficznej. Błona jest zawinięta w czarny papier dla ochrony przed światłem. Potem błonę wywołamy tak, jak każdą inną, zawierającą np. zdjęcia z wakacji.
Co zobaczymy?
Wykonaliście mniej więcej taki eksperyment, jak ten który doprowadził Henryka Becquerela do odkrycia promieniotwórczości!
I cóż znajdziecie na błonie po wywołaniu?
Na błonie zobaczycie ślad odpowiadający rozmieszczeniu soli uranowej.
Niektóre z promieni wysyłanych przez uran przejdą przez papier. Zabierając uran i silnie oświetlając zawiniętą w czarny papier błonę możemy wykazać, że czarny papier zatrzyma światło - po wywołaniu filmu nie zobaczymy śladu zaczernienia. Światło nie mogło przejść przez papier, ale promieniowanie z uranu mogło!

2.2. Czy promieniowanie jądrowe jest takie, jak promieniowanie rentgenowskie?
Promienie X przestają wychodzić z lampy rentgenowskiej, gdy wyłączymy napięcie zasilające. Z promieniotwórczością jest inaczej – strumień promieniowania wydobywa się z uranu w sposób ciągły ... nie potrzeba do tego żadnej energii elektrycznej!
Możemy jednak znaleźć taki rodzaj promieniowania jądrowego, który bardzo przypomina promienie X.
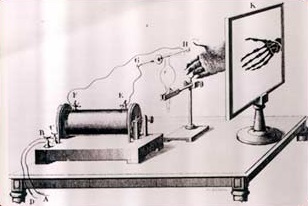
są promienie X i na ekranie K pojawia się kościec ręki.
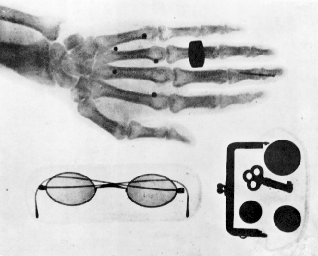
2.3. Promieniowanie jądrowe czyni powietrze przewodzącym
W normalnych warunkach powietrze nie jest najlepszym przewodnikiem elektryczności. Możemy to sprawdzić ładując urządzenie zwane elektroskopem, który pokazuje obecność na nim ładunku elektrycznego. Elektroskop pozostaje z reguły naładowanym przez jakiś czas, co pokazują rozsunięte złote listki.
Kiedy jednak zbliżymy do niego źródło promieniotwórcze, ładunki elektryczne odpłyną przez powietrze, listki rozładują się i zejdą się.
Promienie X mogą również uczynić powietrze przewodzącym. Licznik Geigera (Autor, dla uproszczenia, nie korzysta z pełnej nazwy Licznika Geigera-Müllera - przyp.tłum.) pozwala na wzmocnienie tego efektu i zarejestrowanie nawet pojedynczej cząstki jonizującej.
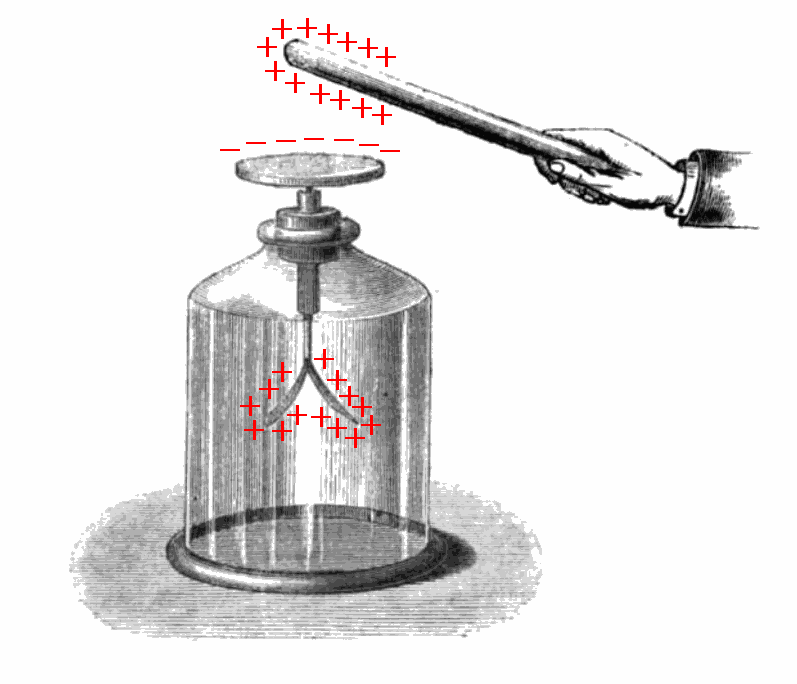
2.4. Widoczne ślady promieniowania: błyski światła, ślady w powietrzu
Promieniowanie, gdy padnie na pewne substancje, powoduje czasem powstawanie delikatnych błysków światła. Aby je zobaczyć trzeba przez pewien czas przebywać w ciemności, aby przyzwyczaić do niej oczy. To, co widać, to nie blask, lecz pojedyncze błyski! Wygląda na to, że promieniowanie z materiału promieniotwórczego składa się z cząstek, z których każda powoduje powstanie jednego błysku.
Czasami takie cząstki mogą zostawiać ślady w komorze wypełnionej wilgotnym powietrzem – komorze mgłowej.


wyrzucane z niektórych promieniotwórczych atomów.
Dłuższe ślady odpowiadają cząstkom o większej energii.
2.5. Co nam to wszystko mówi o promieniowaniu jądrowym?
Wszystkie opisane wcześniej zjawiska mają coś wspólnego. Promieniowanie oddziałuje z atomami w błonie światłoczułej, z powietrzem lub parą w komorze mgłowej, itd. i odłącza elektrony od atomów. Elektrony są małymi składnikami atomów przenoszącymi ładunek elektryczny – prąd elektryczny w przewodzie jest przenoszony przez poruszające się elektrony.
Potem powiemy więcej o elektronach, ale istotne jest, że odłączone elektrony czynią powietrze przewodzącym prąd oraz to, że wywołują inne efekty.
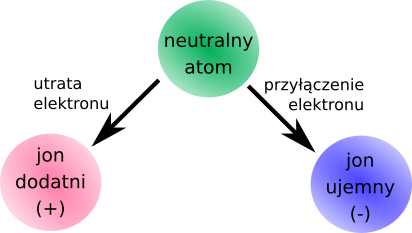
Atom z wybitym elektronem nazywamy „jonem”, a o takim atomie mówi się, że jest „zjonizowany”. Oto dlaczego słyszycie czasami, że promieniowanie rentgenowskie i promieniowanie jądrowe są 'promieniowaniem jonizującym'.
Elektron ma ładunek ujemny, a atom pozbawiony elektronu ma ładunek dodatni. Jeżeli elektron dołącza do dodatniego jonu, ładunki ujemny oraz dodatni znoszą się i otrzymujemy obojętny elektrycznie atom.
Jeżeli atom elektrycznie obojętny traci elektrony, staje się jonem dodatnim, jeżeli przyłącza – jonem ujemnym.
2.6. Różne rodzaje promieniowania jądrowego
Stwierdziliśmy, że promieniowanie jądrowe jest jonizującym.
Jakie dalsze właściwości posiada? Czy istnieje tylko jeden rodzaj promieniowania jądrowego?
Są trzy główne rodzaje promieniowania jądrowego, nazwane od trzech pierwszych liter alfabetu greckiego:
| α | alfa |
| β | beta |
| γ | gamma |
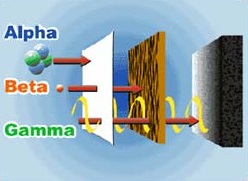
Pierwszą cechą jaka je odróżnia jest to, jak silnie są pochłaniane:
Promienie alfa przebiegają w powietrzu tylko kilka centymetrów i są pochłaniane nawet przez pojedynczą kartkę papieru - nie są one w stanie przejść przez skórę.
Promienie beta są nieco bardziej przenikliwe i przejdą przez kilka kartek papieru.
Promienie gamma są dużo bardziej przenikliwe, przejdą przez 10-centymetrową warstwę wody (czasem dużo grubszą), a nawet przez względnie grubą blachę. Później stwierdzimy, że zależy to od energii promieniowania gamma.
2.7. Promienie alfa, beta i gamma?
Czym są promienie alfa, beta i gamma?
Czy promieniowanie jądrowe tworzone jest przez strumień cząstek naładowanych, jak np. elektrony? Jeśli by tak było, to w jaki sposób mielibyśmy się o tym dowiedzieć?
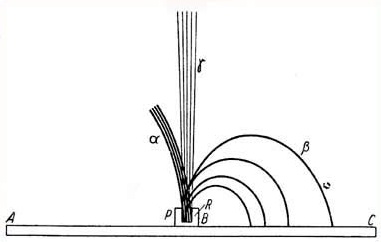
2.8. Co się wydarzy, gdy cząstki promieniowania jądrowego przejdą przez pole magnetyczne?
Jeżeli naładowana cząstka porusza się w polu magnetycznym, między biegunami magnesu, to będzie na nią działała siła zakrzywiająca tor cząstki. To ta sama siła, która działa na elektrony poruszające się w przewodzie, i która odpowiedzialna jest za wprawienie w ruch silnika elektrycznego.
Cóż więc będzie się działo jeśli cząstki alfa i beta oraz promienie gamma będą przechodziły przez silne pole magnetyczne?
Dla danego pola magnetycznego i danej prędkości cząstki, siła działająca na cząstkę naładowaną jest proporcjonalna do jej ładunku. Z faktu, że cząstka alfa ma ładunek 2-krotnie większy niż elektron (ale przeciwnego znaku) wynika, że dla określonych wartości natężenia pola magnetycznego i prędkości cząstki, elektron ma 8000:2=4000 większe przyspieszenie niż cząstka alfa (masa cząstki alfa jest około 8000 razy większa niż masa elektronu - przyp. tłum).
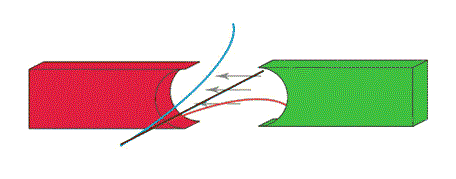
Kiedy cząstki alfa, beta i gamma wydostawszy się ze źródła promieniotwórczego trafią w silne pole magnetyczne, będą odchylane przez to pole w różny sposób.
Wyobraź sobie pole magnetyczne skierowane prostopadle do płaszczyzny ekranu, na który właśnie patrzysz.
Cząstki alfa są odchylane nieco w lewą stronę, cząstki beta są silnie odchylane w prawą, a promienie gamma wcale się nie odchylają.
Tak więc promienie alfa i beta muszą być strumieniami cząstek naładowanych, natomiast promienie gamma nie mogą mieć ładunku elektrycznego.
2.9. Ładunek elektryczny
Pionierzy badań promieniotwórczości stwierdzili, że cząstki alfa i beta są odchylane w polu magnetycznym w przeciwnych kierunkach. To dowodzi, że muszą mieć przeciwne ładunki elektryczne. Ustalono, że cząstki beta mają ujemny ładunek (jak elektrony) oraz że cząstki alfa mają ładunek dodatni. W istocie rzeczy, cząstki beta, to były elektrony!
Dużo później odkryto inny rodzaj cząstek beta, podobnych do opisywanych pierwotnie, ale o ładunku dodatnim. Te nowe cząstki są pozytonami – antycząstkami elektronów.
Mówimy o rozpadzie beta z elektronami jako o rozpadzie „beta minus”, a gdy w rozpadzie powstają pozytony – o rozpadzie „beta plus”.
Kiedy cząstka spotyka antycząstkę, wtedy obie znikają, a jednocześnie wyzwala się energia.
Na rysunku poniżej widzisz czystą energię zamienioną na materię! Kiedy foton (pakiet energii świetlnej) oddziałuje z materią, może dojść do przeciwnego zjawiska niż gdy elektron i jego antycząstka anihilują. Jeśli foton ma wystarczająco dużą energię, może zniknąć, a w jego miejsce mogą pojawić się elektron i pozyton. Na rysunku widzisz ślad elektronu zakręcający w polu magnetycznym w jedną stronę i pozytonu, z jego przeciwnym ładunkiem, zakręcający w drugą stronę. Obie te cząstki były zarejestrowane w komorze pęcherzykowej.

2.10. Odchylcie to jak bety (i alfy)!
Ale dlaczego cząstki alfa tylko nieznacznie odchylają się w polu magnetycznym? Może mają bardzo mały ładunek, a może wielką masę?
Ciężka cząstka (taka o dużej masie) ma dużą bezwładność. Oznacza to, że potrzeba dużej siły aby wprowadzić ją w ruch lub zahamować, albo zmienić jej tor. Siła wywierana przez pole magnetyczne nie zakrzywi toru ciężkiej cząstki tak bardzo, jak w wypadku cząstki lżejszej.
Możesz pchać autobus aż zsiniejesz z wysiłku, ale go nie poruszysz ... jego bezwładność jest wielka. Ale lekkie kopnięcie piłki wyrzuca ją daleko w boisko. W ten sam sposób pole magnetyczne ma większe trudności ze zmianą toru cząstki alfa niż toru elektronu. Jak mówiliśmy, cząstka alfa ma masę około 8000 razy większą od masy elektronu.
Kolejnym świadectwem dużej masy cząstek alfa są bardzo wyraźne ślady w komorze mgłowej pozostawiane przez te cząstki. Ślady te sugerują, że cząstki alfa dają silny efekt jonizacji, kiedy zderzają się z atomami gazu. Elektrony zostawiają delikatniejsze ślady (które prawie nigdy nie są tak proste jak pozostawiane przez cząstki alfa - przyp. tłum.). Większość śladów ma tą samą długość w powietrzu (kilka cm), ponieważ cząstki alfa w większości mają taką samą energię, ale kilka dłuższych śladów wskazuje, że niektóre cząstki alfa mają energię większą niż pozostałe.



W ciągu kilkunastu lat od odkrycia promieniotwórczości nauczyliśmy się czym są promieniowania alfa, beta i gamma.
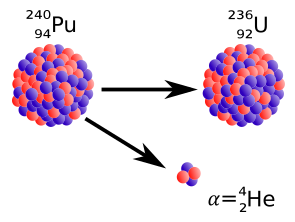
Cząstki alfa są jądrami atomów helu. Wyjaśnimy później co to znaczy. Na razie musimy przypomnieć, że większość masy atomu jest skupiona w maleńkim jądrze zlokalizowanym w środku atomu.
Cząstki alfa, lub jądra helu, mają dodatni ładunek dwukrotnie większy od ładunku cząstki beta i mają masę około czterech atomów wodoru.
W dalszej części będzie dużo więcej na temat atomu.
Obecnie wiemy, że istnieje elementarna (najmniejsza) ilość ładunku elektrycznego. Elektron przenosi taką jednostkę ujemnego ładunku, zaś cząstka alfa – dwie takie jednostki, tyle że ładunku dodatniego.
Cząstki alfa
W 1909 roku E. Rutherford i T. Royds opublikowali artykuł opisujący cudowne doświadczenie, które ostatecznie udowodniło, że cząstki alfa są jonami helowymi. Autorzy pozwolili cząstkom alfa przenikać przez bardzo cienkie ścianki komory próżniowej. Po rozładowaniu komory znaleźli w niej małą ilość gazu. Obraz linii widmowych na spektrometrze optycznym wykazał, że tym gazem jest hel.
3.1. Wodór i hel – dwa najlżejsze atomy
Atom wodoru jest najlżejszym ze wszystkich atomów. Hel jest drugi w kolejności.
Hel znajdujemy jako gaz uwięziony w skałach zawierających dużo uranu. Było to jednym z pierwszych wskazań, że cząstki alfa mają coś wspólnego z helem. I dzięki temu już w 1903 roku Rutherford określił wiek skał na miliardy lat.

3.2. Cząstki beta (β)
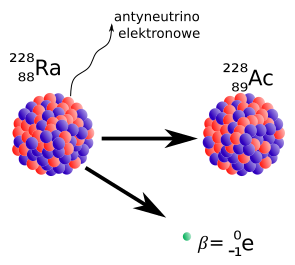
Cząstki emitowane w promieniotwórczości typu beta-minus są elektronami: ujemnie naładowanymi cząstkami obecnymi w każdym atomie.
Są one DUŻO lżejsze niż cząstki alfa. Elektron jest około 2000 razy lżejszy od atomu wodoru, a więc około 8000 razy lżejszy od cząstki alfa.
Elektrony w rozpadzie beta-minus pochodzą z jądra a nie z chmury elektronów.
Drugą cząstką pojawiającą się w rozpadzie jest antyneutrino elektronowe.
Jądra nie mają wewnątrz elektronów ... elektrony w rozpadzie beta są tworzone wewnątrz jądra i następnie wyrzucane z niego z wielką energią! W rozpadzie beta-minus emitowana jest też inna cząstka zwana "neutrinem" (w istocie rzeczy jest to antyneutrino). Te tajemnicze cząstki spotkamy jeszcze. Mogą one łatwo przenikać przez Ziemię i to bez straty energii.
3.3. Promieniowanie gamma (γ)
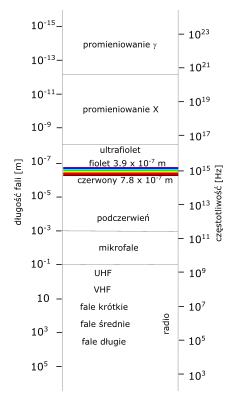
Jakkolwiek promieniowanie gamma wywołuje, podobnie jak strumień cząstek naładowanych, trzaski w liczniku Geigera, nie mówimy o cząstkach gamma, lecz o promieniach gamma. Wynika to z faktu, że promieniowanie gamma jest jednym z rodziny fal elektromagnetycznych, podobnie jak fale radiowe i mikrofale, podczerwień, światło i nadfiolet. Wszystkie one są falami, z których fale radiowe mają falę najdłuższą, a gamma – najkrótszą.
Długość fali to odległość między sąsiednimi wierzchołkami lub dolinami fali.
Promieniowanie elektromagnetyczne nie przenosi ładunku elektrycznego (np. antena TV nie odbiera ładunków elektrycznych z nadajnika!) i dlatego właśnie promienie gamma nie są odchylane przez magnes.
Diagram pokazuje, że między promieniami X i gamma nie ma jakiejś wyraźnej granicy. Niektóre promienie gamma z bryłki uranu mogą mieć falę dłuższą niż promienie rentgena używane np. do badania zębów. Ogólnie jednak biorąc, promienie gamma mają fale najkrótsze.
Światło widzialne lokalizuje się w widmie między podczerwienią i nadfioletem. Jest również jedną z form promieniowania elektromagnetycznego. Wszystkie one mają taką samą naturę, a różnią się tylko długością fali [m] i częstotliwością [Hz].
Jądro atomowe: opowieść o energii.
Niezwykłą cechą promieniotwórczości jest to, że energia pojawia się bez żadnego widocznego działania z zewnątrz.
Podczas gdy jedne substancje promieniotwórcze żyją krótko, inne – jak uran – były i są źródłem energii od miliardów lat.
Kawałek plutonu może zaopatrzyć w energię elektryczną statek kosmiczny na czas jego podróży przez Układ Słoneczny. Zwykłe chemiczne baterie nie nadają się do tego. Baterie z plutonem jednak mogą, a energię z nich pozyskuje się, jak we wszystkich procesach chemicznych, dzięki przemieszczeniom elektronów w zewnętrznych częściach atomów.

4.1. Struktura atomów
Wszystkie przedmioty zbudowane są z atomów pierwiastków (wodór, węgiel, żelazo, uran itd.), które wykazują odpowiednie własności chemiczne.
Jaka cecha odróżnia atomy żelaza od atomu wodoru lub tlenu?
Każdy z atomów zbudowany jest z jądra o dodatnim ładunku, otoczonego elektronami o ładunku ujemnym. Ujemne ładunki elektronów i dodatni ładunek jądra całkowicie równoważą się, więc atom jest elektrycznie obojętny. Każdy elektron obdarzony jest jednostką ujemnego ładunku, jeżeli zatem atom ma np. 6 elektronów, wtedy jądro ma 6 jednostek dodatniego ładunku.
Oto parę przykładów:
| Pierwiastek: | Wodór |
|---|---|
| Jądro: | 1 ładunek dodatni |
| Na zewnątrz jądra: | 1 elektron |
| Wynik: | obojętny atom |
| Pierwiastek: | Hel |
| Jądro: | 2 ładunki dodatnie |
| Na zewnątrz jądra: | 2 elektrony |
| Wynik: | obojętny atom |
| Pierwiastek: | Tlen |
| Jądro: | 6 ładunków dodatnich |
| Na zewnątrz jądra: | 6 elektronów |
| Wynik: | obojętny atom |
| Pierwiastek: | Uran |
| Jądro: | 92 ładunki dodatnie |
| Na zewnątrz jądra: | 92 elektrony |
| Wynik: | obojętny atom |
| Pierwiastek | Jądro | Na zewnątrz jądra | Wynik |
|---|---|---|---|
| Wodór: | 1 ładunek dodatni | 1 elektron | obojętny atom |
| Hel: | 2 ładunki dodatnie | 2 elektrony | obojętny atom |
| Tlen: | 6 ładunków dodatnich | 6 elektronów | obojętny atom |
| Uran: | 92 ładunki dodatnie | 92 elektrony | obojętny atom |
4.2. Atom węgla - pierwiastek życia
Każdy atom węgla ma jądro z sześcioma dodatnimi ładunkami i 6 elektronów na zewnątrz. Sposób organizacji składników atomu opisują specjalne zasady mechaniki kwantowej.
Te prawa, na przykład, decydują o rozmieszczeniu elektronów wtedy, gdy jest ich akurat sześć. Rozmieszczenie owych sześciu elektronów w atomie nadaje węglowi jego specyficzne własności, takie jak skłonność do spalania w tlenie i tworzenia dwutlenku węgla, a czasem również pozwala atomom na zorganizowanie się w strukturę pięknego diamentu.
Oto niezliczone tryliony atomów węgla łączą się z atomami tlenu tworząc dwutlenek węgla.
We właściwych warunkach atomy węgla układają się w piękne kryształy diamentu. Diament jest najtwardszą znaną substancją.

Zdjęcie: Rudy and Peter Skitterians z Pixabay

Zdjęcie: EWAR z Pixabay
Usuwając pojedynczy ładunek ujemny z obojętnego atomu pozostawisz jon o pojedynczym dodatnim ładunku.
4.3. Liczba atomowa, Z
Liczba dodatnich ładunków w jądrze atomowym, która jest również liczbą elektronów w atomie, nazywa się liczbą atomową; jest ona oznaczana zawsze literą Z.
Dla węgla Z = 6. Dla najprostszego ze wszystkich atomów - atomu wodoru - Z = 1, dla helu zaś Z = 2.
Ale co powoduje, że atom węgla ma sześć dodatnich ładunków, atom wodoru jeden, a helu dwa?
| pierwiastek | Z |
|---|---|
| H | 1 |
| He | 2 |
| C | 6 |
| N | 7 |
| O | 8 |
| K | 19 |
| Ca | 20 |
| Fe | 26 |
| Ag | 47 |
| Sn | 50 |
| Au | 79 |
| Pb | 82 |
| U | 92 |
Powyżej widzisz tabelę z liczbami atomowymi kilku pierwiastków chemicznych, od wodoru (H) do uranu (U).
4.4. Proton
Dodatnio naładowaną cząstkę, nadającą wszystkim jądrom atomowym ich ładunek elektryczny, nazwano protonem. Proton ma masę prawie 2000 razy większą od masy elektronu.
Protony twojego ciała stanowią około 2000 razy większą masę od masy elektronów, ponieważ ciało zawiera jednakową liczbę elektronów i protonów.
Co by się stało, gdyby liczby elektronów i protonów twojego ciała nie były równe?

4.5. Jądra atomowe to nie same protony!
Prócz protonów jądra atomowe zawierają cząstki innego rodzaju – neutrony. Te nie mają ładunku elektrycznego, są elektrycznie obojętne (neutralne) – stąd ich nazwa. Masa neutronu jest prawie taka sama jak protonu.
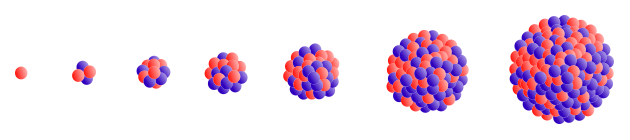
Jądra, zbudowane z protonów (czerwone) i neutronów (niebieskie), od lewej do prawej: wodór (1 proton), hel (2 protony,2 neutrony), węgiel (6 protonów, 6 neutronów), tlen (8 protonów, 8 neutronów), żelazo (26 protonów, 30 neutronów), cyna (50 protonów, 70 neutronów), ołów (82 protony, 126 neutronów).
Źródło: Behacker & Partner
Jądro atomu wodoru zwykle nie zawiera neutronów, a tylko jeden proton (później wyjaśnimy, o co chodzi), hel zaś ma zwykle 2 protony i 2 neutrony. Oto dlaczego mogliśmy powiedzieć, że cząstka alfa ma 4 razy większą masę od jądra wodoru.
4.6. Izotopy
Większość jąder atomów wodoru nie ma neutronów, niektóre jednak mają jeden, a nawet dwa neutrony. To liczba protonów wyznacza dodatni ładunek jądra, a więc również liczbę elektronów w atomie. Własności chemiczne atomu bardzo mało zależą od liczby neutronów. To liczba Z, liczba protonów, decyduje, z atomem jakiego pierwiastka mamy do czynienia. Jądra atomowe o tej samej liczbie Z, lecz o różnej liczbie neutronów N, nazywamy izotopami (pierwiastka o liczbie atomowej Z). Poniższa tabela pokazuje różne liczby protonów i neutronów dla wybranych, ważnych izotopów.
| Pierwiastek | Izotop | Z liczba protonów | N liczba neutronów | A = Z + N liczba masowa |
|---|---|---|---|---|
| Wodór | 1H | 1 | 0 | 1 |
| Wodór | 2H | 1 | 1 | 2 |
| Wodór | 3H | 1 | 2 | 3 |
| Węgiel | 12C | 6 | 6 | 12 |
| Węgiel | 14C | 6 | 8 | 14 |
| Tlen | 16O | 8 | 8 | 16 |
| Tlen | 18O | 8 | 10 | 18 |
| Potas | 39K | 19 | 20 | 39 |
| Potas | 40K | 19 | 21 | 40 |
| Uran | 235U | 92 | 143 | 235 |
| Uran | 238U | 92 | 146 | 238 |
| Pierwiastek i izotop | Z | N | A = Z + N |
|---|---|---|---|
| Wodór 1H | 1 | 0 | 1 |
| Wodór 2H | 1 | 1 | 2 |
| Wodór 3H | 1 | 2 | 3 |
| Węgiel 12C | 6 | 6 | 12 |
| Węgiel 14C | 6 | 8 | 14 |
| Tlen 16O | 8 | 8 | 16 |
| Tlen 18O | 8 | 10 | 18 |
| Potas 39K | 19 | 20 | 39 |
| Potas 40K | 19 | 21 | 40 |
| Uran 235U | 92 | 143 | 235 |
| Uran 238U | 92 | 146 | 238 |
| Z - liczba protonów | |||
| N - liczba neutronów | |||
| A=Z+N - liczba masowa | |||
W każdym przypadku podajemy trzecią liczbę - A, liczbę masową, która jest równa łącznej liczbie protonów i neutronów; A=Z+N
4.7. Trochę więcej o izotopach
Oto jeszcze kilka innych izotopów bardzo ważnych w medycynie i przemyśle: 11C, 13N, 15O, 18F, 60Co, 99Tc. Ich liczby atomowe wynoszą odpowiednio: 6, 7, 8, 9, 27 i 43. Cztery pierwsze izotopy oraz ostatni są używane w diagnostyce medycznej, piąty zaś jako silne źródło promieni gamma o różnych zastosowaniach.
4.8. Znikające jądra
Żaden izotop spośród ratujących życie jąder atomowych, 11C, 13N, 15O, 18F, 60Co lub 99Tc, nie występuje w ziemskich minerałach. Muszą być one wytworzone w urządzeniach zwanych cyklotronami lub w reaktorach jądrowych. Powodem tego, że nie mogą być znalezione w minerałach jest to, że są wszystkie niestabilne, to znaczy ulegają rozpadowi promieniotwórczemu. Niektóre z nich rozpadają się tak szybko, że szpitale potrzebują cyklotronów do produkcji ich na miejscu - nie trwają dość długo, by mogły być dowożone z większych odległości.
Kiedy jądro emituje cząstki alfa lub beta, zmienia się w jądro innego rodzaju. Mówimy, że ulega transmutacji (przemianie). Przez setki lat alchemicy próbowali przemienić jedne pierwiastki w inne, przeważnie ołów w złoto. Ale jądra promieniotwórcze zmieniają się jedne w drugie przez cały czas. Oto dlaczego 11C, 13N, 15O, 18F, 60Co lub 99Tc nie występują na Ziemi w stanie naturalnym.
Te konkretne izotopy znikają i zamieniają się w izotopy innych pierwiastków emitując cząstki beta.
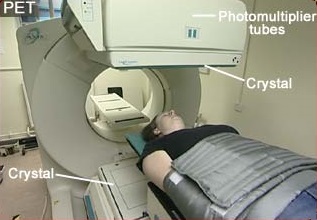
Pacjent diagnozowany z użyciem PET (Pozytonowej Tomografii Emisyjnej). W tej technice badawczej używa się często niestabilnego izotopu 18F, który istnieje godzinę lub dwie (dokładnie jego okres połowicznego zaniku wynosi 110 minut) i jest przeważnie wytwarzany w szpitalnym cyklotronie.
Słowniczek: Photomultiplier tube - fotopowielacz; Crystal - kryształ scyntylatora
Jeżeli jądro atomowe ma 26 protonów, innymi słowy jego liczba atomowa Z=26, wtedy jest to atom żelaza. Gdybyś badał żelazo w rudzie żelaza z kopalni, lub jakiekolwiek żelazo znalezione na Ziemi (lub w przestrzeni pozaziemskiej!) możesz być pewnym, że jądra atomów znalezionego żelaza będą miały 28, 30, 31 lub 32 neutrony. Innymi słowy, możesz znaleźć jedynie te cztery izotopy żelaza.
Jakie są liczby masowe tych czterech izotopów żelaza? W jaki sposób napiszesz ich symbole?
W każdym przypadku należy dodać do liczby protonów atomu żelaza (26) odpowiednią liczbę neutronów. Liczba masowa wyniesie odpowiednio 54, 56, 57 i 58.
Możesz je zapisać jako 54Fe, 56Fe, 57Fe i 58Fe.
Inne izotopy żelaza mogą istnieć, ale tylko przez krótki czas. Izotopy te są promieniotwórcze i zanikają bardzo szybko po wytworzeniu. Te zaś, które istniały wtedy i były promieniotwórcze, kiedy powstawała Ziemia, zanikły dawno temu.
Na przykład izotop 59Fe ma zbyt wiele neutronów. 58Fe z 32 neutronami jest O’K, ale 33 neutrony w 59Fe, to zbyt wiele.
W ostatnich latach uczeni wytworzyli izotopy żelaza zawierające zaledwie 19 neutronów lub aż 43 neutrony, oba jednak mają bardzo krótki czas życia.
5.1. Ile jądro chciałoby mieć neutronów?
Żelazo jest dość typowym pierwiastkiem chemicznym. Jeżeli jego jądro ma trochę więcej neutronów (28, 30, 31 lub 32) niż protonów (26), to jest zadowolone.
Jeżeli zaś tych neutronów jest dużo więcej lub dużo mniej niż 26, to jądro szybko wyemituje jakieś cząstki, aby poprawić równowagę między ilością protonów i neutronów. Innymi słowy – będzie promieniotwórcze.
Jądro ołowiu na 82 protony. Następujące izotopy ołowiu nie są promieniotwórcze: 204Pb, 206Pb, 207Pb, 208Pb.

Czym by byli hydraulicy bez ołowiu? Na ten ołów składa się 1,4% 204Pb, 24,1% 206Pb, 22,1% 207Pb i 52,4% 208Pb.
5.2. Promieniotwórczość przywraca równowagę!
Jeżeli w jądrze jest zbyt wiele protonów lub neutronów, ma ono zbyt wiele energii i używa jej do wytworzenia nowych cząstek, a jednocześnie poprawia równowagę między liczbą protonów i neutronów w jądrze. Dla przykładu, jądro o zbyt wielu neutronach wytwarza elektron i wyrzuca go na zewnątrz – to rozpad beta. Kiedy elektron jest wyemitowany, ubywa z jądra ładunek ujemny a elektrycznie obojętny neutron staje się dodatnio naładowanym protonem. Odebranie ujemnego ładunku daje taki efekt, jak dodanie ładunku dodatniego.
Rozpad beta, w którym emitowany jest elektron (mający ładunek ujemny) jest często nazywany promieniotwórczością „beta-minus”. Z promieniotwórczością „beta-plus” spotkamy się wkrótce.
W międzyczasie, czy możesz odgadnąć, w jakich jądrach przydarza się rozpad beta-plus?
To jądra ze zbyt wieloma protonami w stosunku do liczby neutronów.
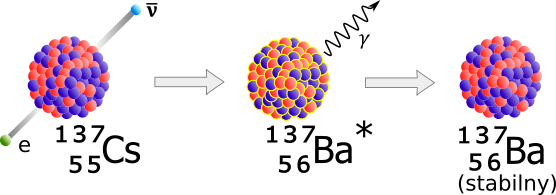
To jądro cezu (Z=55) ma zbyt wiele neutronów (82), co daje A=137. Ostatecznie powstaje i jest emitowany elektron o ładunku ujemnym, zaś jeden z neutronów zamienia się w proton. W tym samym czasie jest wysłane niemal niewykrywalne antyneutrino.
W rezultacie powstałe jądro 137Ba, izotop baru, powstaje z nadmiarem energii, której pozbywa się przez emisję kwantu gamma.
5.3. Rozpad beta-minus w akcji
Oto przykład promieniotwórczości beta-minus, która jest ważna w medycynie i przemyśle.
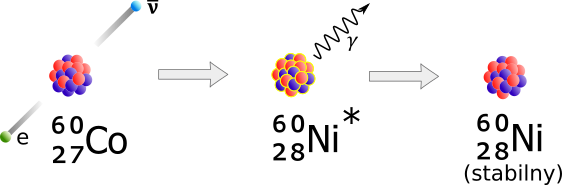
Izotop 60Co ma 27 protonów i 33 neutrony. To zbyt wiele neutronów jak na jądro z 27 protonami. W efekcie końcowym jeden neutron zamienia się w proton, przy jednoczesnej kreacji i emisji wysokoenergetycznego elektronu (cząstki beta).
W rozpadzie beta łączna liczba protonów i neutronów, czyli liczba masowa atomu (A), nie zmienia się.
5.4. Rozpad gamma - jak wykorzystać 60Co
Promienie beta nie wnikają głęboko w materię i nie są bardzo użyteczne w medycynie i przemyśle (w przeciwieństwie do promieni gamma - przyp. tłum.). 60Co nie jest ważny z powodu swoich cząstek beta, lecz z powodu wysokiej energii promieniowania gamma emitowanych z jąder 60Ni, powstających w rozpadzie beta 60Co.
Jądra 60Ni powstają z wielkim nadmiarem energii. Jedynym sposobem na pozbycie się tej energii jest wysłanie jej w postaci promieniowania gamma. Promieniowanie to jest tak potężne, że może sterylizować sprzęt medyczny, wykrywać usterki w łopatach turbin silników odrzutowych lub niszczyć nowotwory.
Sprzęt medyczny, jak gumowe rękawiczki, bandaże, strzykawki, soczewki kontaktowe itp., może być sterylizowane przy użyciu intensywnych wiązek promieni gamma. Często do tego celu używamy, jako źródła, izotopu 60Co wyprodukowanego w reaktorze jądrowym.
5.5. A gdy jądro ma za mało neutronów?
Węgiel, z liczbą atomową Z=6, ma dwa izotopy stabilne: 12C i 13C. Azot (Z=7) ma również dwa stabilne izotopy – 14N i 15N.
Izotopy 11C i 13N są ważnymi izotopami w medycynie.
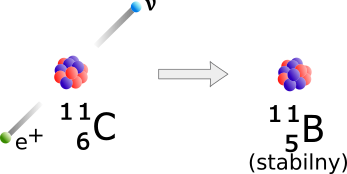
11C ma 5 neutronów, a to zbyt mało jak na jądro o 6 protonach, a 13N ma tylko 6 neutronów, co też jest za mało jak na jądro z 7 protonami. Jeżeli wyemitują elektron, ich jądra staną się jeszcze bardziej dodatnie (neutron zamieni się w proton), a przecież one już wcześniej miały zbyt mało neutronów. Owe jądra przejdą rodzaj rozpadu beta zwanego rozpadem „beta-plus”. Zjawisko to było odkryte w 1934 roku przez Irenę i Fryderyka Joliot-Curie. Irena była córką Marii Skłodowskiej-Curie i Piotra Curie.
5.6. Promieniotwórczość beta-plus
Pozyton odkryto w 1932 roku. Pozyton jest antycząstką elektronu – jest dokładnie taki jak elektron, lecz przenosi jednostkę dodatniego ładunku elektrycznego, a nie ujemnego jak elektron. W rozpadzie beta-plus proton zamienia się w neutron, a z jądra wyrzucany jest pozyton.

Pierwszy dowód istnienia pozytonu - antycząstki elektronu. Ślad w komorze mgłowej zagięty jest w polu magnetycznym w niewłaściwą stronę, aby był on wywołany elektronem. To niespotykane odkrycie Andersona było wysoce kontrowersyjne - do czasu potwierdzenia go w późniejszych latach. (zdjęcie dzięki uprzejmości C.D.Andersona)
W rozpadzie beta-plus izotopu 11C jeden z protonów zamienia się w neutron i pozyton (anty-elektron), a w zasadzie niewykrywalne neutrino unosi energię rozpadu. W wyniku rozpadu powstaje stabilny izotop 11B.
Wszystkie cząstki, nie tylko elektrony, mają swoje antycząstki. Proton i neutron również. Jeżeli wymienisz uścisk dłoni z anty-osobą z anty-galaktyki, zamienicie się obaj w równoważną energię i unicestwicie otaczające was miasto!
5.7. Promieniotwórczość typu alfa
Są granice dopuszczalnej liczby neutronów i protonów w jądrze atomowym.
Żadne z jąder występujących na Ziemi nie ma więcej niż 238 nukleonów (składników jądra). Największe jądro jest jądrem uranu-238: zawiera ono 92 protony i 146 neutronów. Nawet to jądro zawiera zbyt wiele protonów i neutronów, aby mogło trwać wiecznie. Jądra 238U stale rozpadają się emitując cząstki alfa, czyli jądra helu-4.
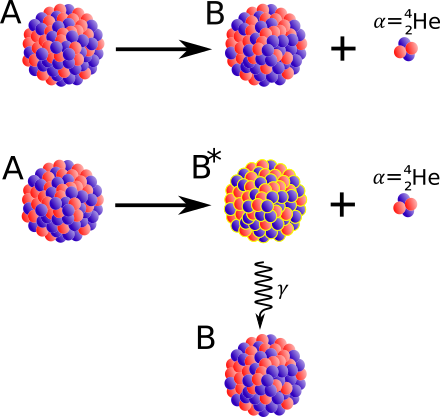
Często zdarza się, że gdy jądro A emituje cząstkę alfa, pochodne jądro B nie ma nadmiaru energii. Mówimy wtedy, że jest ono w "stanie podstawowym"; cząstka alfa ma wtedy energię maksymalną. Jednak czasami, jak na ilustracji, nowe jądro występuje w stanie wzbudzonym. W tym przypadku nadmiar energii jest wyrzucany z jądra w postaci kwantów promieniowania gamma (γ).
5.8. Jak uran zamienia się (ostatecznie) w ołów
Kiedy jądro ulega rozpadowi alfa liczba A maleje o 4, zaś liczba Z o 2.
Jądro powstające w wyniku emisji przez 238U cząstki alfa jest również niestabilne. W rezultacie, nim powstanie stabilny izotop 206Pb nastąpi cała seria rozpadów alfa i beta. Informacja o zawartości 206Pb jest użyteczna przy datowaniu skał o wieku miliardów lat. W czasie schodzenia w dół z liczbą masową, od 238U do 206Pb, mamy do czynienia z wysyłaniem wielu cząstek alfa i beta, a także promieniowania gamma. Właśnie promieniowanie gamma jest tym, które powoduje większość trzasków w liczniku Geigera znajdującym się w pobliżu granitu lub rudy uranowej.
| Izotop | Rozpad | Czas połowicznego rozpadu |
|---|---|---|
| 238U | alfa | 4,5 x 109 lat |
| 234Th | beta | 24,1 dni |
| 234mPa | beta | 1,2 minut |
| 234U | alfa | 245 000 lat |
| 230Th | alfa | 75 400 lat |
| 226Ra | alfa | 1600 lat |
| 222Rn | alfa | 3,8 dni |
| 218Po | alfa | 3,1 min. |
| 214Pb | beta | 26,8 min. |
| 214Bi | beta (→214Po) alfa (→210Tl) | 20 min. 164 x 10-6 s |
| 210Pb | beta | 22,2 lat |
| 210Bi | beta | 5 dni |
| 210Po | alfa (→ 206Pb) | 138 dni |
Podane czasy oznaczają okresy połowicznego rozpadu dla danej przemiany jądrowej.
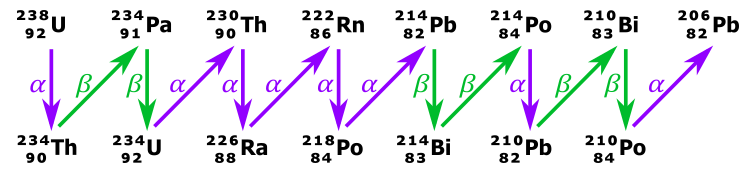
Pierwiastek Th to tor, Ra to rad, Pa to protaktyn, Rn – radon (gaz powstający w twoim domu
z domieszki rudy uranowej w materiałach budowlanych), Po to polon, Bi to bizmut, zaś Pb to oczywiście ołów.
5.9. Widzialny rozpad alfa

Niesamowite: te niewyobrażalnie małe cząstki alfa wysyłane z jąder atomowych zostawiają widoczne ślady kropelek wody w przesyconej parze wodnej. Tak się dzieje dlatego, że bardzo szybkie i niosące ładunek cząstki jonizują cząsteczki powietrza. Jony stają się ośrodkami kondensacji, na których powstają kropelki.
Kiedy jądro się rozpada?
Jak długo jądro może trwać pomiędzy rozpadami?
Nawet jeżeli duża liczba jąder 14C powstanie w tym samym czasie, nie ulegną one jednocześnie rozpadowi beta do 14N mimo, że są całkowicie identyczne. Nie mają one bowiem wmontowanych małych zegarów, mówiących im, kiedy nadejdzie czas rozpadu.
Wszystko, co możemy powiedzieć, to tylko to, że po określonym czasie, zwanym okresem połowicznego zaniku, połowa z nich się rozpadła. Nie możemy przewidzieć kiedy dane jądro rozpadnie się. Dla każdego jądra jest to rodzaj loterii.
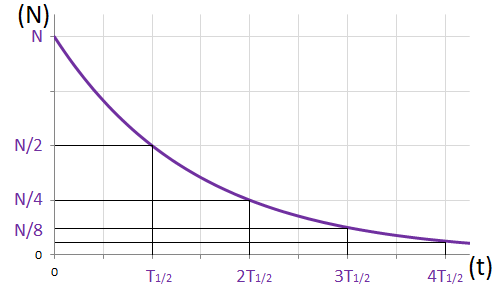
Powiedzmy, że uruchamiamy stoper w chwili, którą przyjmujemy za zero, a w naszej próbce mamy wtedy dużą liczbę N identycznych jąder promieniotwórczych.
Po czasie równym okresowi połowicznego zaniku zostanie ich średnio połowa, a więc N/2. Po dwóch okresach połowicznego zaniku pozostanie znów połowa, a więc N/4. Po trzech okresach - N/8, itd.
6.1 Nie ma połówek jądra atomowego!
A ile jąder zostanie, jeśli na początku było np. 9 jąder 14C? Czy otrzymamy 4½ jądra? Nie! Rozpad promieniotwórczy jest procesem statystycznym. Tylko średnio połowa jąder zostanie po okresie połowicznego zaniku. Rzeczywista liczba będzie bliska połowie jeśli jest ich bardzo wiele.
Fakt, że nie można powiedzieć kiedy rozpadnie się dane jądro, lecz jedynie ile jąder rozpadnie się, gdy będzie ich bardzo wiele, przypomina sytuację z rzutem kostką do gry. Jeżeli rzucisz 600 razy, jest całkiem prawdopodobne, że otrzymasz około 100 „szóstek”. Ale nie masz żadnej gwarancji, że rzucając 6 razy, otrzymasz jedną „szóstkę”!
6.2 Wielki zakres okresów połowicznego zaniku
Okres połowicznego zaniku 238U wynosi około 4,5 miliarda lat, co odpowiada dość dokładnie wiekowi Ziemi, od kiedy uformowała się z chmur pyłu i gazu.
Tak więc, około połowa pierwotnego 238U rozpadła się ostatecznie do 206Pb i pewnej ilości helu powstałego z cząstek alfa. Nie wszystkie nuklidy mają jednak tak długi okres połowicznego zaniku. Izotop polonu, 212Po, ulega rozpadowi alfa zanikając o połowę co około jednej milionowej części sekundy. (Pierwiastek polon był odkryty przez Marię Skłodowską-Curie i nazwany tak od jej kraju pochodzenia – Polski).
6.3 Okresy połowicznego zaniku użytecznych izotopów
Mamy wielki zakres długości okresów połowicznego zaniku - od kilku miliardów lat do mniej niż jednej milionowej sekundy – i wiele tych charakterystycznych czasów leży pomiędzy tymi granicami. Tablica obok pokazuje okresy połowicznego zaniku dla izotopów o ważnych zastosowaniach w medycynie, przemyśle i pracach badawczych.
| Izotop | Okres połowicznego zaniku |
|---|---|
| 11C | 20,4 minut |
| 14C | 5730 lat |
| 13N | 10 minut |
| 40K | 1,3 miliarda lat |
| 60Co | 1925 dni |
Widzimy całkiem szeroki zakres okresów połowicznego zaniku! Tabela ta pomoże Ci odpowiedzieć na następujące pytania:
Wszyscy zawieramy potas (K) w naszych ciałach, który czyni nas zaledwie lekko promieniotwórczymi z dwóch powodów. Jeden jest taki, że większość potasu nie jest 40K. Czy patrząc w tabelę możesz wskazać drugi powód?
Bardzo długi okres połowicznego zaniku oznacza, że każdy nuklid 40K ma bardzo małe prawdopodobieństwo rozpadu w danym przedziale czasu. Jądra z krótkim okresem połowicznego zaniku są daleko bardziej promieniotwórcze.



 Raymond Mackintosh jest Nowozelandczykiem zamieszkałym w Zjednoczonym Królestwie Wielkiej Brytanii. Ukończył studia w Auckland, a pracę doktorską obronił na Uniwersytecie Kalifornijskim w Berkeley. Od wielu lat prowadzi badania z fizyki jądrowej, od 1979 roku naucza na Otwartym Uniwersytecie w UK.
Raymond Mackintosh jest Nowozelandczykiem zamieszkałym w Zjednoczonym Królestwie Wielkiej Brytanii. Ukończył studia w Auckland, a pracę doktorską obronił na Uniwersytecie Kalifornijskim w Berkeley. Od wielu lat prowadzi badania z fizyki jądrowej, od 1979 roku naucza na Otwartym Uniwersytecie w UK.